The chemical times 06no2(通巻0号)17 化学分析における基礎技術の重要性(5) 25イオン交換滴定法 硫酸ナトリウムなどの中性の塩 類の純度試験では、イ従って、キレート滴定に使用する場合、溶解後直ちに滴定する必要がある。 実際には、JIS K8001の指示薬の項にも記載されているように、本品をK 2 SO 4 で粉砕希釈して使用する(希釈率1:0で、NN diluted with potassium sulfateの商品名で販売)。(キレート滴定編) 181 日本工業化学教育研究会 (中和の場合は、pHの変化をするため洗い流さない。 読み取り、滴定後の使用量を求める(jis k 0050 附属書 c(参考)容量分析の一般的

書籍紹介 分析化学の基礎 木村 優 中島理一郎 共著 化学
キレート滴定 ph10 理由
キレート滴定 ph10 理由-<化学>キレート滴定関連で質問です。 滴下する溶液に、kohを加えるのですが、phを高くする為に使用する。という事ですが、どんな作用で何でその必要があるんですか? また遮蔽剤とは何のことでしょう? 化学的理Ca2+,Mg2+のキレート滴定における金属指示薬とpHの関係は次のとおりである。 Ca2+ とMg2+ はpH 10でEBTを指示薬として同時に滴定される。しかし,EDTAで Ca2+ のみを直接滴定する場合,Ca2+ EBT錯体の生成定数*)が小さく(当量点のpMと指


キレート滴定行ったのですが 緩衝溶液を入れる理由が分かりません Phの変化 Yahoo 知恵袋
Edtaによるキレート滴定に関しては、ph10前後で行われることが多いので、ebt自体は 青色のhin 2が安定状態となります。 金属にEBTが配位して、 赤色の MIn – 錯体 を形成しており、EDTAとの交換反応によって、 赤色の MIn – 錯体 から、 青色の HIn 2 へと変化します。がって,キ レート滴定の選択性を高めるためには,い ろ いろの手段が講ぜられているが,そ のおもなものをあげ れば, (1) EDTAを 滴定試薬として用いる場合 a pHの 調節による選択性の向上 b 選択的いんぺい剤の応用 (2) EDTA以 外の選択的滴定試薬を用いる。PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。
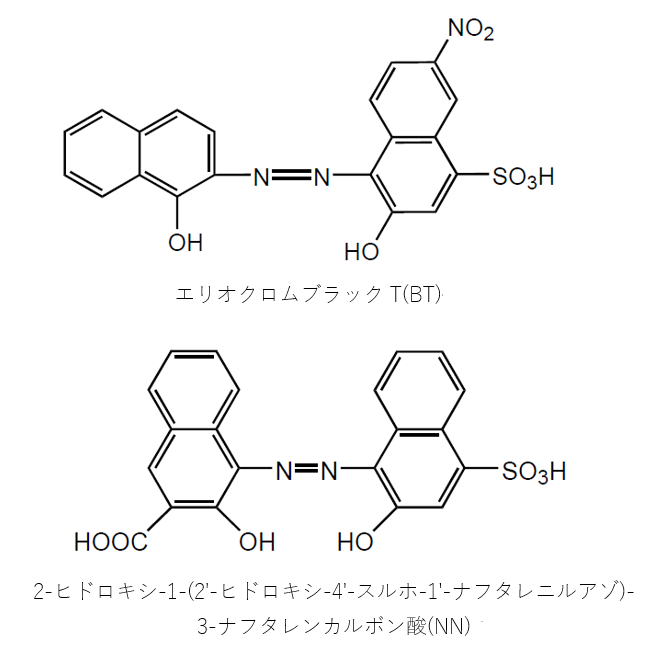
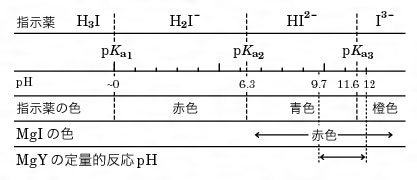
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=634.キレート滴定 41 001Medta標準溶液の調製 要点 キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム 塩h2na2y・2h2oでetaと表示されている。この試薬は結晶水以外に多少の水分を含んでキレート滴定法の原理 表1金属‐edtaキレート 表1酸解離定数 表2キレート安定度定数 表3 ph領域および指示薬
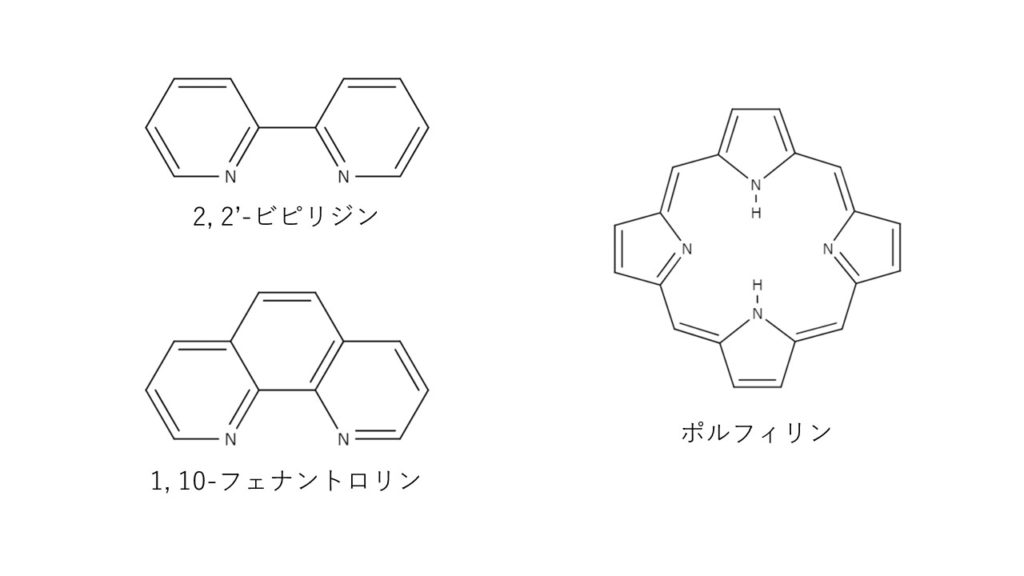
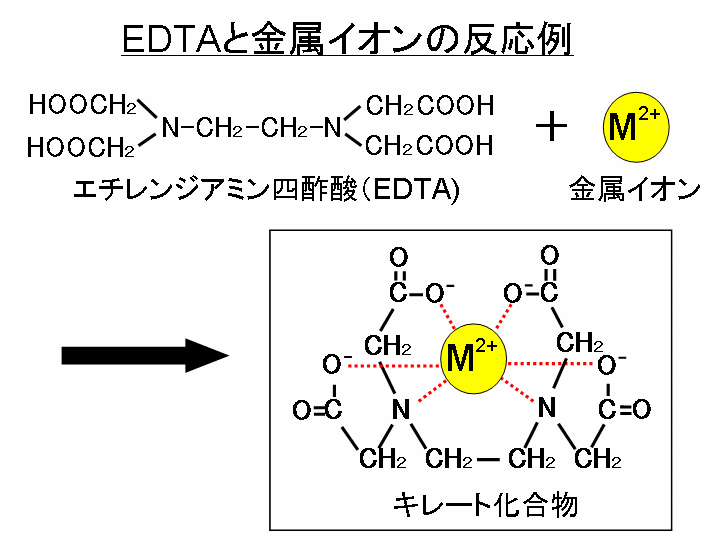
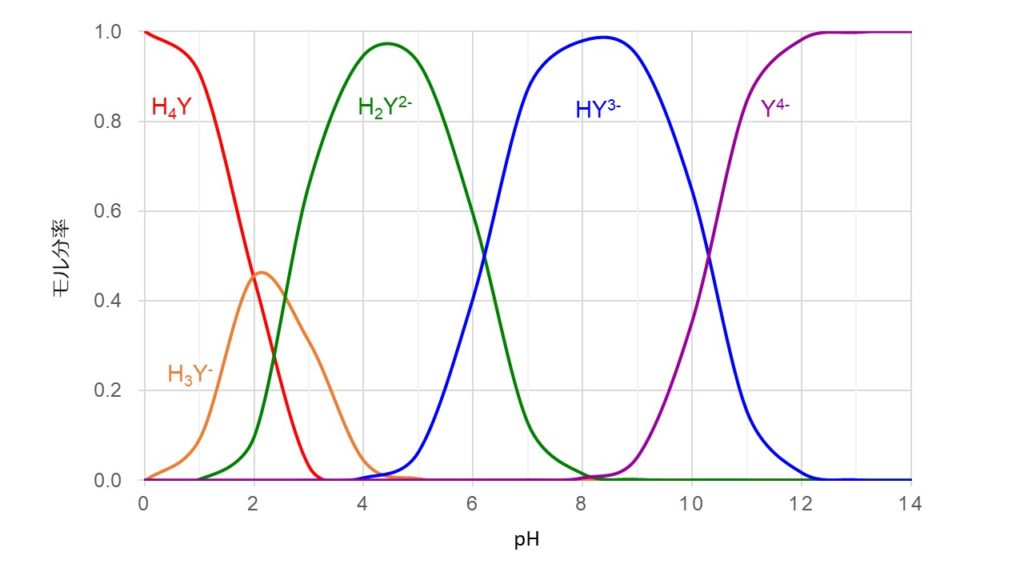
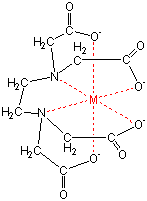
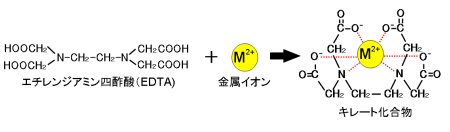
キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ( ) pH = 57の場合、分子形:イオン形 =1:10である。 ( ) pH = 47の場合、分子形分率は50 %である。PH10の溶液中ではカルシウムもマグネシウムもイオンの状態(Ca 2 とMg 2 )で存在しますので,両方ともキレートを生成します(全硬度).pH12ではマグネシウムは水酸化物Mg (OH) 2 になり,キレートを生成しないと考えられます(Ca硬度).さらに強い塩基性ではカルシウムも水酸化物Ca (OH) 2 になり,キレートを生成しないと予想されます.しかし,EDTAや指示薬がそのキレート滴定(キレートてきてい、chelatometric titration )とは、錯滴定の一種で、錯形成試薬としてキレート試薬と呼ばれる多座配位子を用いるもの。 この容量分析法は金属 イオンの迅速で簡単な定量法の1つとして広く用いられている。 主なキレート試薬としてEDTA(エチレンジアミン四酢酸
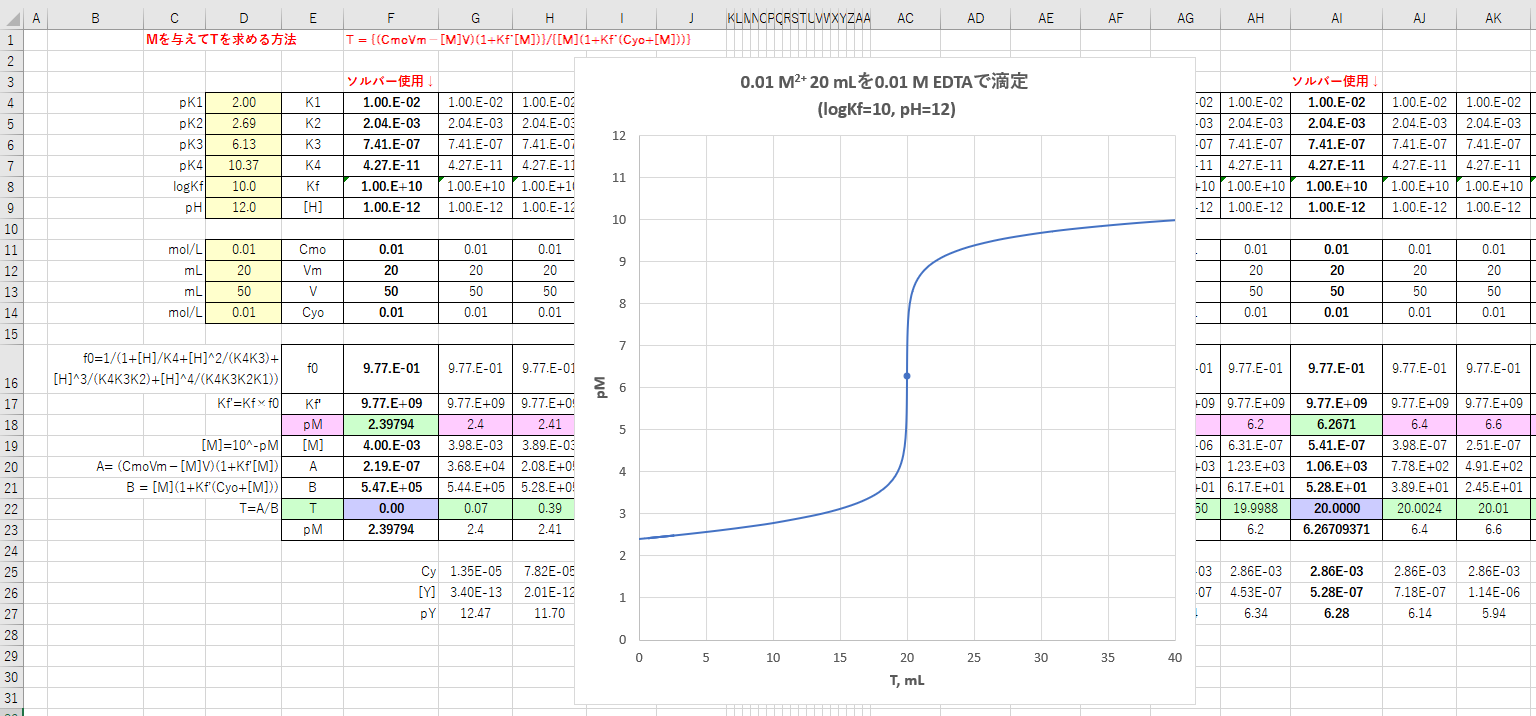


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて


Edtaを用いた硬度計算の問題があります カルシウムイオン マグ Yahoo 知恵袋
キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ( ) pH = 57の場合、分子形:イオン形 =1:10である。 ( ) pH = 47の場合、分子形分率は50 %である。キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定に



水の硬度測定
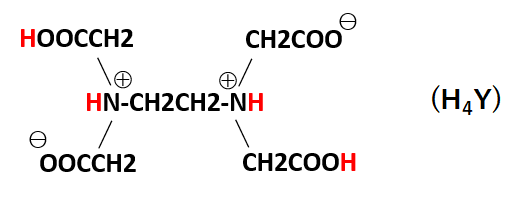


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて
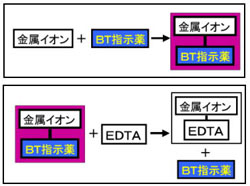
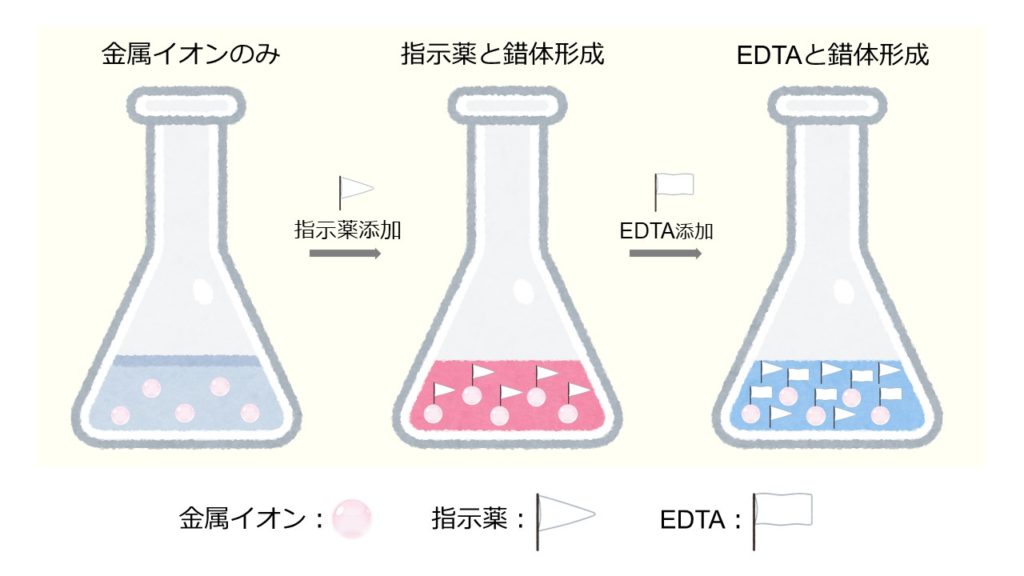
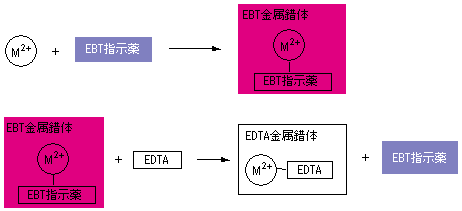
EDTAを加えるとキレート効果で置換されるためNN、BTは遊離して青を示す。 高pH条件ではMgが水酸化物沈殿を生じるため、pHの変化のみで定量が可能。 (3) トリエタノールアミンを加えた理由 EDTAとの錯生成に干渉する金属イオンのマスキング(特にAlやFe)① 鉄(Ⅱ)イオンおよび鉄(Ⅲ)イオンの逐次滴定について 本法は、鉄(Ⅱ)イオンのedta キレート安定定数が酸性領域では小さいことから、共存す る鉄(Ⅲ)イオンとedta が選択的に反応することを応用した測定法です。測定できるphBT指示薬はpH10付近では青色を呈するが、Ca 2+ 、Mg 2+ などの金属イオンを含む溶液中に加えるとキレート化合物を生成し、赤紫色を呈する。 次に、この溶液にEDTA標準溶液を滴下すると,EDTAの方がBT指示薬よりも、Ca 2+ 、Mg 2+ とキレート化合物を作りやすいため、Ca 2+ 、Mg 2+ はEDTAと結合して無色のキレート化合物となり、反応終了とともに溶液の色は遊離したBT


質問箱


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf
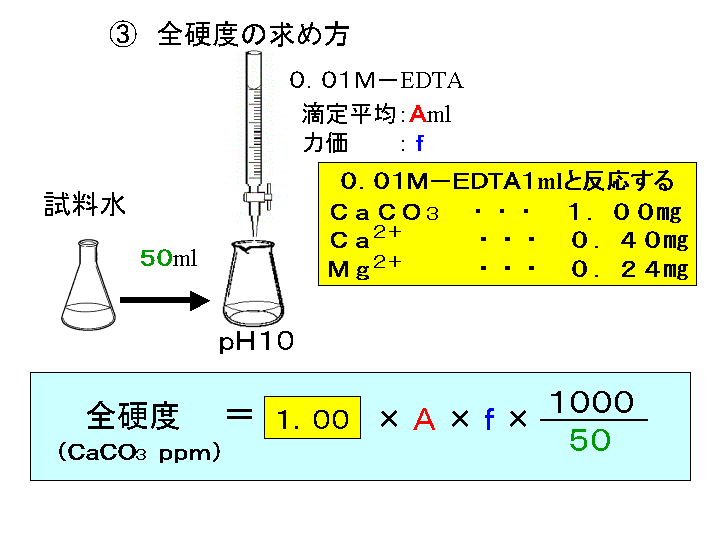
ホールピペットを用いて,Mg 2 を含む試水10 mLを100 mLビーカーに取る. 緩衝液(Na 2 B 4 O 7 ‐Na 2 CO 3, pH 10) 2 mLをメートルグラスで測り取り,加える.3 なぜ滴定される溶液の ph は、 5 ~ 6 を維持しなければならないのか。 4 ph 6 における h 2 edta 2 – のモル分率を計算しなさい。 edta は、次の酸解離定数を持 つ弱酸である。 k1 = 10 × 10 – 2, k2 = 21 × 10 – 3, k3 = 69 × 10 – 7, k4 = 55 × 10 – 11 5 試料溶液中の cu試料の温泉水を精確に5倍に希釈し、まずカルシウムとマグネシウムの合量をpH 10程度でEDTAによるキレート滴定で定量する。 次に、試料に水酸化カリウムを加えpH1213 として滴定する。 高いpHではマグネシウムは水酸化マグネシウムMg (OH) 2 として沈澱しEDTAと
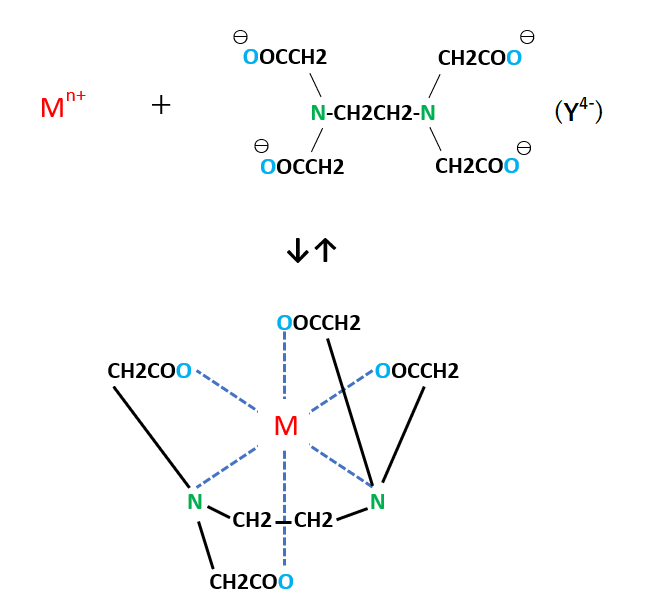


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
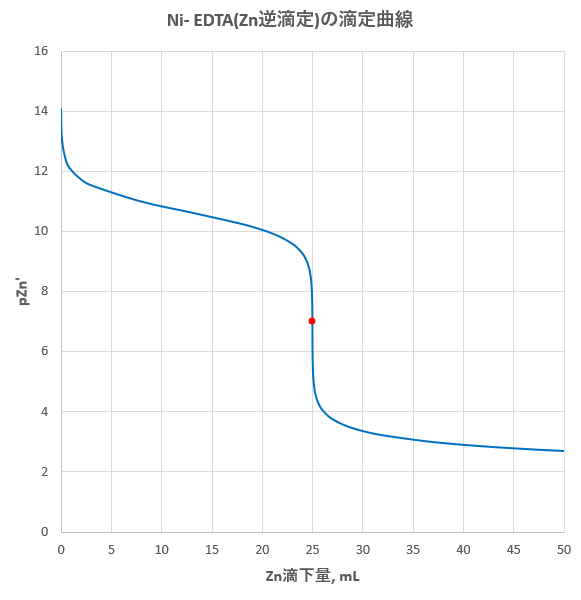
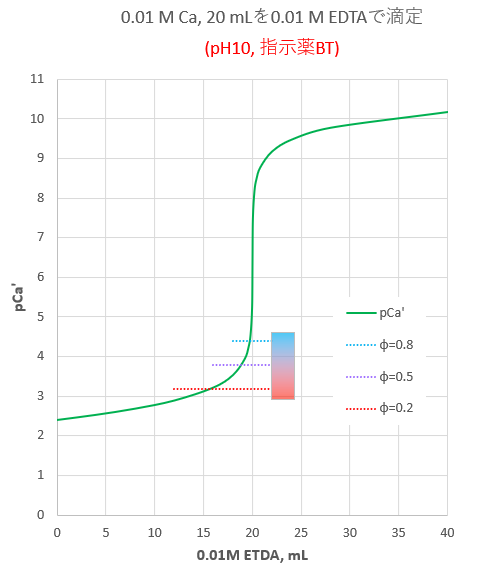
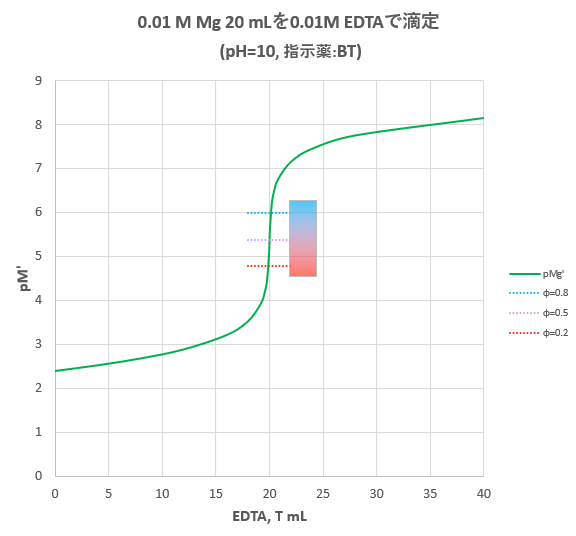
グラフより、たとえば、 pH=2 では、Ca 2+ はEDTAとほとんどキレートを生成しないので、Ca 2+ が共存しても Fe 3+ のみを定量的に滴定できる。 pH=7 では、Mg 2+ を有効数字4桁で滴定するには適当ではなく、pH=10 が必要。また、pH=7 での M gの滴定曲線は当キレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。安利辅酶q10用量(共6篇)辅酶q10 惊人的10大功效辅酶q10 惊人的10大功效 1、心脏疾病的预防和治疗辅酶q10的缺乏,通常心脏第一个受到影响,几乎所有的证据都表明,辅酶q10能提高心肌功能,有效治疗各种心肌病、抗心律失常、心绞痛,心力衰竭,辅酶q10能增加心力衰竭的存活力达300%。


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf



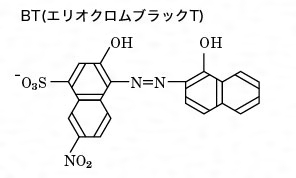
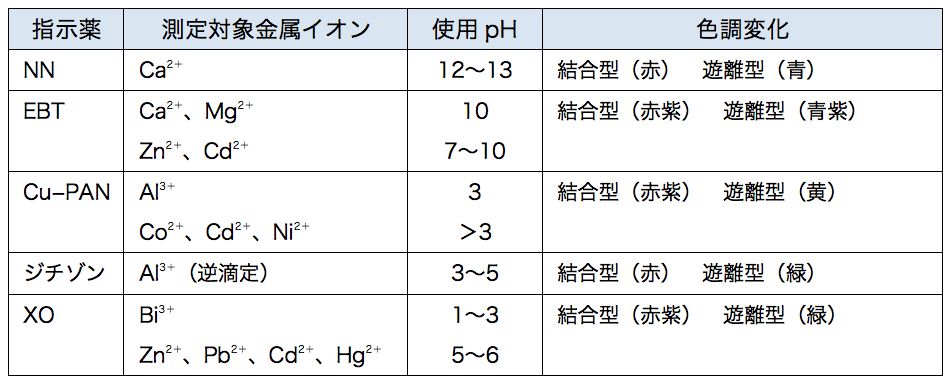
比色試薬 金属指示薬 Bt 同仁化学研究所
Dna分解酵素阻害剤としてのキレート剤 dna分解酵素であるdnaseは,その活性発現にmg 2 を必要とします. そして,teのバッファーの "e" は, edta のことです. dnaの保存で teバッファー を使う理由は以下の2点です. ・phを塩基性に保つことで,dnaを脱プロトン化して沈殿するのを防ぐ.キレート滴定に用いられる主な金属指示薬を以下に示す。 金属指示薬については、目的金属イオンとEDTAとのキレート形成に最適なpHで変色する指示薬を選択する必要がある。 3 医薬品の定量 <例:塩化カルシウム水和物(CaCl 2 ・2H 2 O:)の定量>Ie キレートは酸性では解離し易くなる ところで、キレート滴定が定量的であるためには、 Kf´> 10 8 または、 log Kf´>8 であるから、この条件を満足する pH (下限の pH )が存在。 Ex Cd 2+:Kf=400 ×10 16 or log Kf=166 log αH=log Kf−log Kf´= 166 −8=86


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf



エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
キレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラルA ベストアンサー 理由1:金属イオンとキレートが結合する強さ(安定度定数)は、pHによって変化する。 pHが低いほど結合は弱くなるので、できれば高pH域でやりたい。 理由2:しかし、金属イオンはpHが高くなると水酸化物の沈殿になり、キレート滴定キレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。
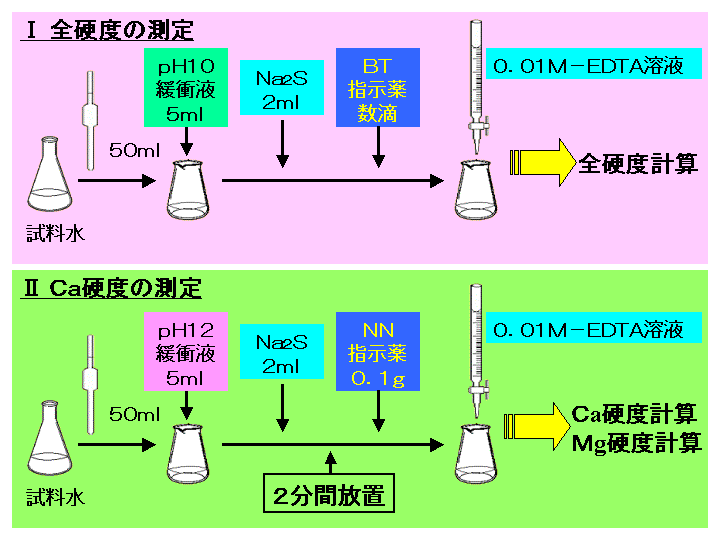


水の硬度測定 キレート滴定



水の硬度測定


Q Tbn And9gcrp47vzkoskzc7jxnacxsy52aakla3h0zcrk8xkexeyc37zrvep Usqp Cau
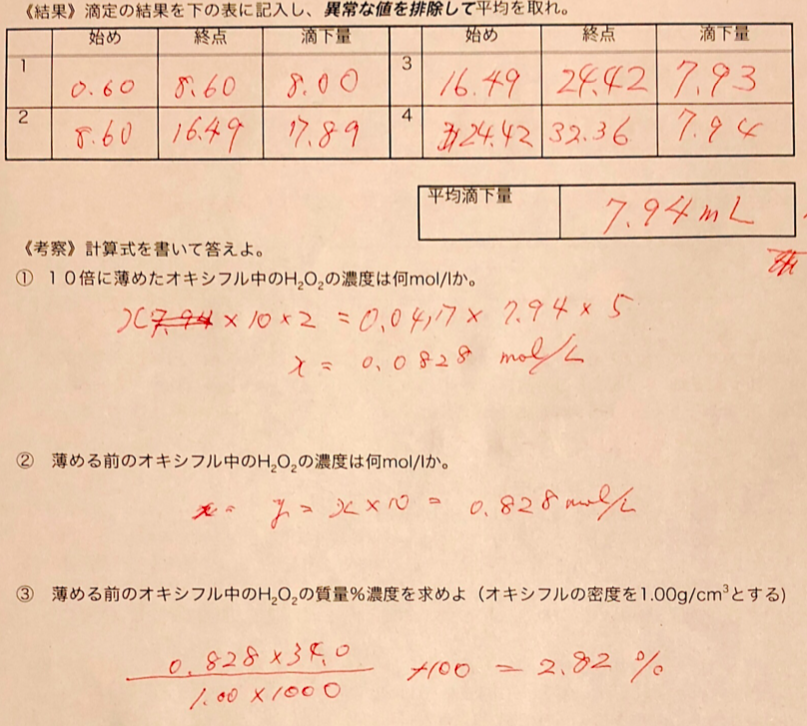


無料印刷可能 酸化 還元 滴定 考察 画像ブログ



比色試薬 金属指示薬 Bt 同仁化学研究所
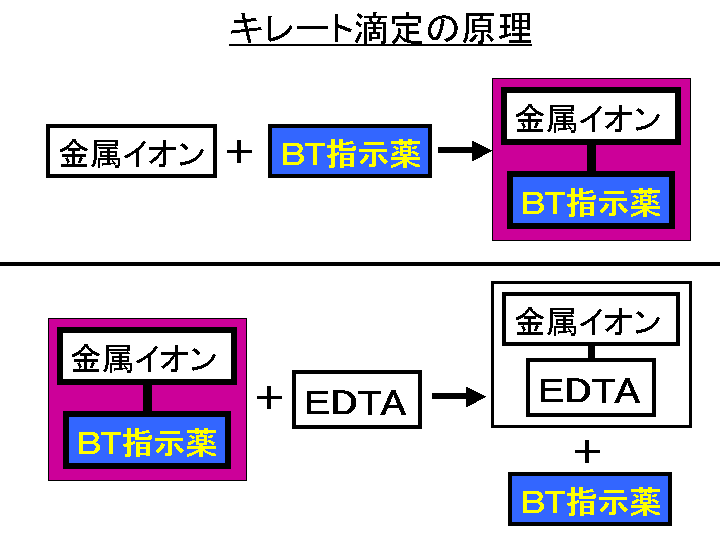


水の硬度測定 キレート滴定


Q Tbn And9gcslnr7xvncpdc8gcykrmlld5kgoukub5ngjsy1bwhktq Fahwo Usqp Cau



水の硬度測定 キレート滴定


キレート滴定行ったのですが 緩衝溶液を入れる理由が分かりません Phの変化 Yahoo 知恵袋


マイクロスケール化 今までビュレットを用い キレート滴定法で硬度を判断していた 今回は ビュレットを用いず簡易的に硬度を測定する方法を開発し マイクロスケール化をすることで 子ども達にも安易に実験ができるようにする 準備物 材料



キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス


マイクロスケール化 今までビュレットを用い キレート滴定法で硬度を判断していた 今回は ビュレットを用いず簡易的に硬度を測定する方法を開発し マイクロスケール化をすることで 子ども達にも安易に実験ができるようにする 準備物 材料


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf


2


キレート滴定のレポートでキレート滴定では緩衝液を加え液のphを一定に保つ Yahoo 知恵袋


Http Gp Csj Jp Media Common Gp04 2a Pdf


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Obmブログ バイオ バイオ学科在校生 環境分析実習


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf
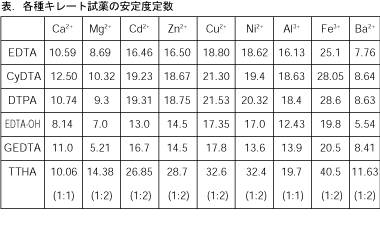


Column


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com


Http Timetraveler Html Xdomain Jp Pdf 5 4 Chelate Pdf


水の硬度測定 キレート滴定


キレート滴定のedat溶液の標定においてアンモニア緩衝液を使用した Yahoo 知恵袋


2cのページ


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


2


Www Ps Toyaku Ac Jp Yanagida Bunsekipdfs 10th11 Pdf


Http Www Ees Hokudai Ac Jp Ems Kakomon 12 3 Pdf


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Http Www Tmd Ac Jp Artsci 10education 10shizen 10p91 Pdf


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋



キレート滴定



書籍紹介 分析化学の基礎 木村 優 中島理一郎 共著 化学


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf



無料印刷可能 酸化 還元 滴定 考察 画像ブログ


マイクロスケール化 今までビュレットを用い キレート滴定法で硬度を判断していた 今回は ビュレットを用いず簡易的に硬度を測定する方法を開発し マイクロスケール化をすることで 子ども達にも安易に実験ができるようにする 準備物 材料


キレート滴定とは コトバンク


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Edta 滴定曲線 溶解度などーエクセルを用いて


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf



キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス


Http Www Fumi Theory Com Img Tyxiii 5 Pdf


Edta 滴定曲線 溶解度などーエクセルを用いて
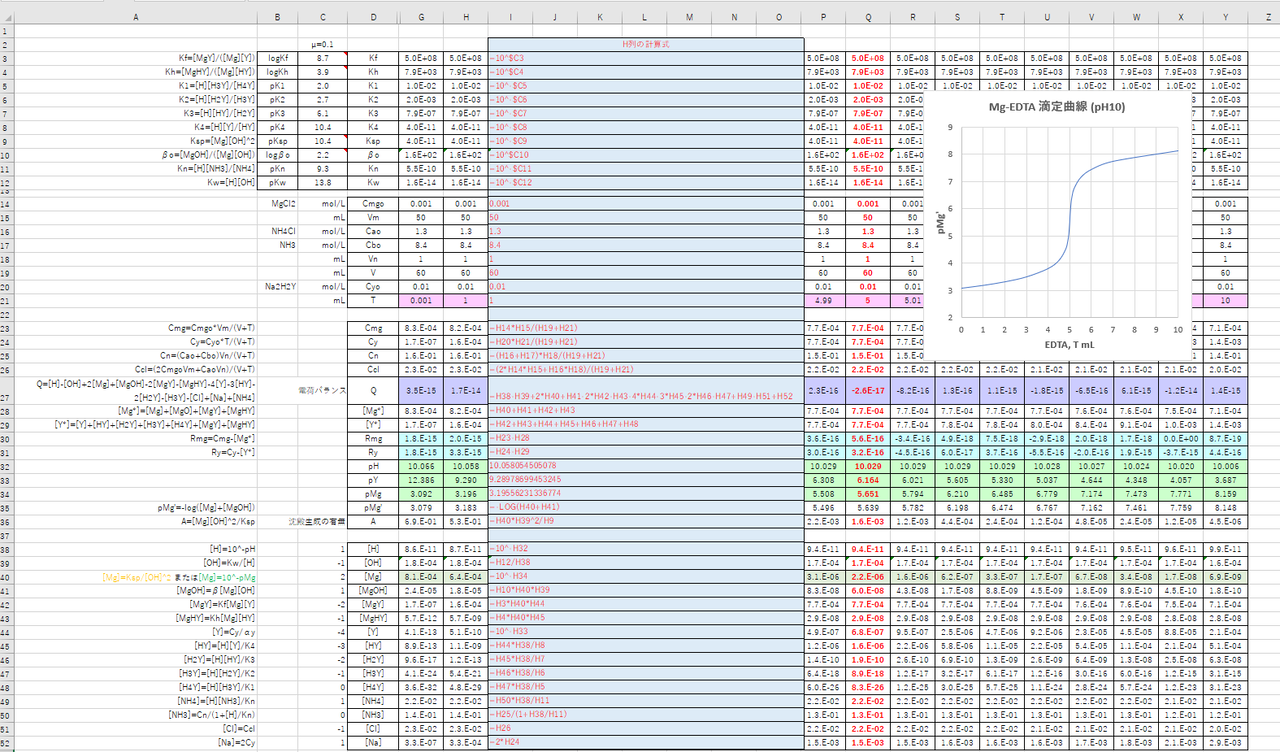


Edta 滴定曲線 溶解度などーエクセルを用いて


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com


キレート滴定とは コトバンク
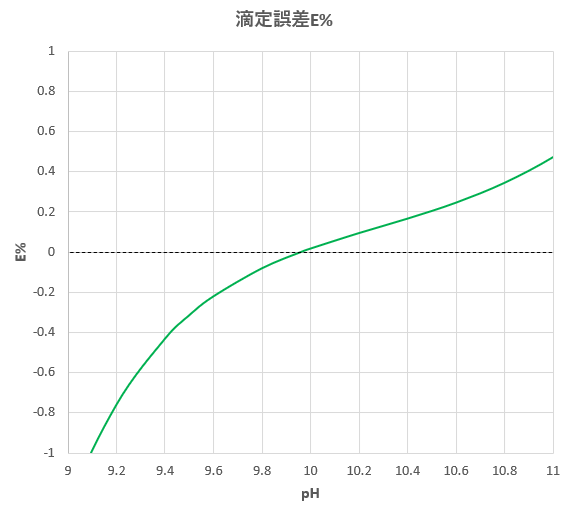


Edta 滴定曲線 溶解度などーエクセルを用いて


水の硬度測定


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Q Tbn And9gcsajbo0yjujwl0flbhcpah4ueahlqyqwsrmtcdqh0km3wjrwcbd Usqp Cau


Www Chem S U Tokyo Ac Jp 99past Graduate H17 Senmon Pdf



ダウンロード可能 キレート滴定 考察 人気のある画像を投稿する


化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋



水の硬度測定


無料印刷可能 酸化 還元 滴定 考察 画像ブログ


Http Gakusyu Shizuoka C Ed Jp Science Ronnbunshu H27 Pdf



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


2


Www Kitami It Ac Jp Wp Content Uploads 19 09 R02 Bussitukagakukaitou 1 Pdf



キレート滴定


水の硬度測定 キレート滴定


分析化学キレート滴定 問濃度0 010mほca2 水溶液5 Yahoo 知恵袋



無料印刷可能 酸化 還元 滴定 考察 画像ブログ


Http Gakusyu Shizuoka C Ed Jp Science Ronnbunshu H27 Pdf


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Q Tbn And9gctzb7vnfo 97bof A56whpfy4cbec5ygo B4px36wnisrb18lwp Usqp Cau


Http Www Fumi Theory Com Img Tyxiii 1 Pdf


水の硬度測定


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf



ダウンロード可能 キレート滴定 考察 人気のある画像を投稿する


キリヤ Q A


水の硬度測定 キレート滴定


Edta 滴定曲線 溶解度などーエクセルを用いて


水の分析


Www Gsj Jp Data Meth Chem Anal Gsj Ca 29 1963 Pdf


水の硬度測定 キレート滴定


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋


キレート滴定で質問聞いて下さい 丸矢印のところがわかりません 教え Yahoo 知恵袋


2


キレート滴定 Yakugaku Lab


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Edta 滴定曲線 溶解度などーエクセルを用いて


Http Www Hachikou H Shiga Ec Ed Jp Course Chemistry Chelate19 Pdf


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf


Www Gsj Jp Data Meth Chem Anal Gsj Ca 40 1968 Pdf



0 件のコメント:
コメントを投稿